Certains gaz peuvent conduire à une explosion lorsqu'ils réagissent entre eux. On synthétise ici un mélange de H2 et de Ci2 qui, sous rayonnement UV, explose.
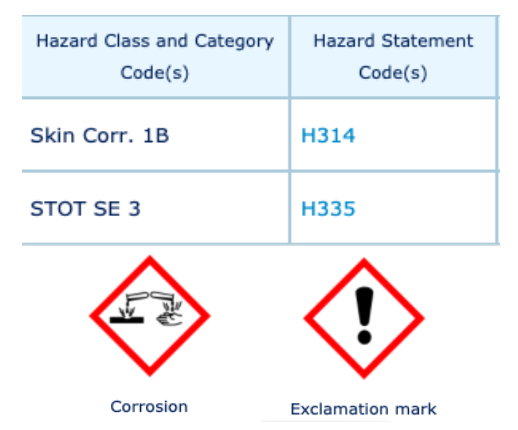
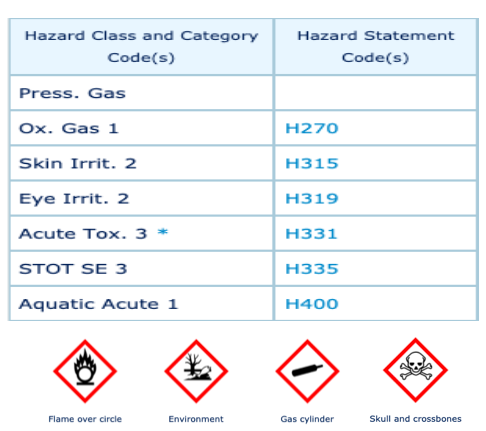
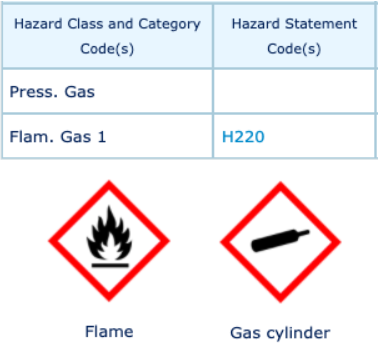
RISQUES ASSOCIÉS AUX PRODUITS CHIMIQUES RENCONTRÉS [1]
Protocole
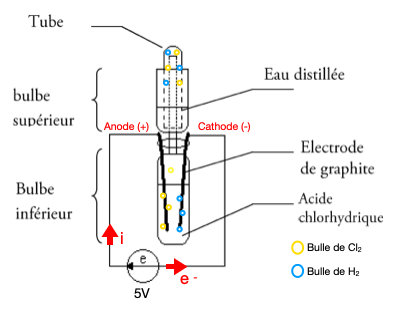
Cette expérience sera réalisée sous une hotte. • On assemble les pièces du montage comme indiqué sur le schéma. • À l'aide d'une pipette remplir au 2/3 le bulbe inférieur d'acide chlorydrique de concentration C=8mol.L-1. Remplir au tiers le tube collecteur d'eau distillée et verser un peu d'eau distillée dans le bulbe supérieur. Renverser alors le tube collecteur sur le bulbe supérieur. • Relier les deux électrodes de graphite aux bornes du générateur de tension et appliquer une tension de 4-5 V. • Une fois le tube collecteur rempli de gaz (attendre une dizaine de minutes), le retirer et le boucher aussitôt en enfonçant légèrement un bouchon en caoutchouc. • Finalement, en orientant le tube avec le bouchon vers le haut, irradier le tube collecteur à l'aide d'une lampe à vapeur de mercure.
Observations
Dès la mise en route du générateur on observe des petites bulles de gaz qui se forment au niveau de chaque électrode. On voit également qu'il y a une accumulation de gaz dans le bulbe supérieur.
Après une dizaine de minutes, on ferme notre tube à l'aide d'un bouchon en caoutchouc. Après seulement quelques secondes d'irradiation à la lampe à vapeur de mercure il y a une légère explosion avec départ du bouchon (voir la vidéo ci-dessous) à forte vitesse dans la hotte. De plus, le tube récupéré est assez chaud.
Vidéo de la récupération du dichlore suivie de l'irradiation à la lampe à vapeur de mercure et de l'explosion.
Analyse
Nous allons séparer l'analyse de cette expérience en 2 parties. La 1ère correspond à l'électrolyse réalisée et la 2ème correspond à l'irradiation.
1ère Partie : l'électrolyse.
On trouve dans la solution les ions H+ et Cl-, ainsi que des molécules d'eau. Les réactions envisageables sont alors:
-à l'anode (oxydation): 2 Cl-(aq)= Cl2(g) + 2 e- ainsi que 2 H2O(l) = O2(g) + 4 H+(aq) + 4 e-
-à la cathode (réduction) 2 H+(aq) + 2 e- = H2(g)
En comparant les potentiels standards à pH=0 (l'acide chloridrique est concentré) des couples (O2/H2O), E°(pH=0)=1,23V, et (Cl2/Cl-), E°(pH=0)=1,36V [3], on devrait s'attendre à l'équation bilan 2 H2O(l) = O2(g) + 2 H2(g) comme l'indique la thermodynamique.
Cependant, on observe que la solution est légèrement jaune caractéristique du Cl2 dissout dans l'eau. En effet, en solution, la couleur jaune est la couleur complémentaire de celle résultant de la transition électronique entre les orbitales HO-1 et la BV de Cl2.
Comment expliquer alors l'oxydation des ions Cl- ?
Jetons un oeil à la cinétique:
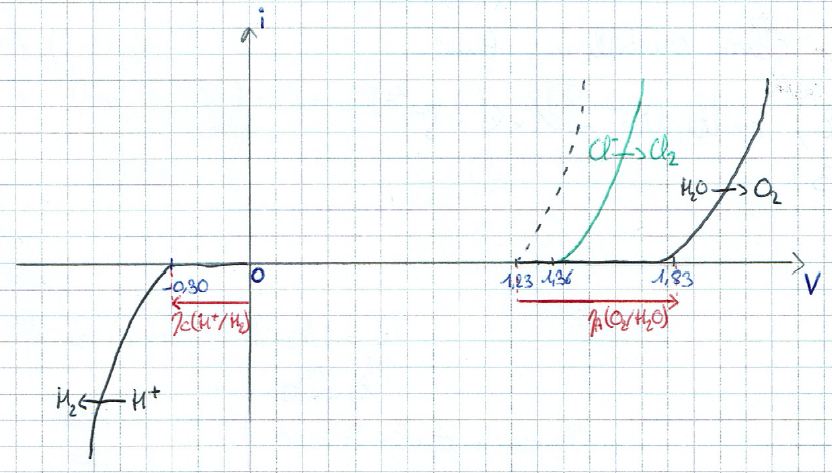
Sur l'électrode de graphite, l'oxydation de H2O est lente avec une surtention anodique 𝜂a(O2/H2O)= +0,600 mV. À l'inverse, il n'y a pas de surtention pour le couple Cl2/Cl- (couple rapide). On peut noter qu'il y a également une surtention cathodique pour le couple H+/H2: 𝜂c(H+/H2)= - 0,300 mV [3].
On a alors les courbes intensité/potentiel suivantes:
Courbes intensité/potentiel des couples en jeu sur électrode de graphite.
Ainsi, le couple Cl2/Cl- n'est pas électro-inerte sur l'électrode de graphite. La réaction globale est donc : 2 H+(aq) + 2 Cl-(aq) = 2 H2(g) + Cl2(g)
2ème Partie : l'irradiation.
La lampe à vapeur de mercure utilisée génère une lumière de longueur d'onde 𝜆 proche de 365nm [4]. D'après la relation de Planck-Einstein, cela correspond à une énergie E= 𝒉c/𝜆 = 5,45.10-19J.
Or, E(Cl-Cl) = 243 kJ/mol et E(H-H) = 435 kJ/mol, soit respectivement 4,03.10-19J et 7,23.10-19J pour une molécule. [5]
Ainsi, l'énergie apportée par la lampe à vapeur de mercure permet la rupture homolytique de la liaison Cl-Cl mais pas celle de la liaison H-H.
On peut donc proposer le mécanisme suivant:
Initiation: Cl2(g)=2 Cl●(g) ΔrH° = 243 kJ/mol
Propagation: Cl●(g) + H2(g) = HCl(g) + H●(g) ΔrH° = 3,69 kJ/mol [6]
H●(g) + Cl2(g) = HCl(g) + Cl●(g) ΔrH° = -188 kJ/mol [6]
Terminaison: 2 H●(g)= H2(g)
2 Cl●(g)= Cl2(g)
Cl●(g) + H●(g) = HCl(g)
Une fois l'initialisation déclanchée par l'irradiation, la propagation est exothermique ΔrH° = -184 kJ/mol. Il y a donc production d'énergie dans le tube.
Par conséquant, toutes les conditions sont réunies pour qu'il y ait une explosion: une production d'énergie, un comburant (O2) présent également dans le tube, un combustible (H2) qui se trouve dans son domaine d'explosivité (entre 4% et 75% [7]), tout cela dans un espace fermé (le tube).
Hexagone de l'explosion [7]
Conclusion
Lors de cette expérience on synthétise plusieurs gaz dangereux. Le dihydrogène est explosif en présence de chaleur, le chlorure d'hydrogène ainsi que le dichlore (très fort oxydant) présente une forte toxicité pour l'être humain, respectivement pour son acidité et son pouvoir oxydant. Pour éviter la synthèse de chlorure d'hydrogène et le dégagement de chaleur qui l'accompagne et il est donc impératif de manipuler à l'abri de la lumière UV (donc du Soleil).
Plus généralement, lors d'une électrolyse, il est important de vérifier la cinétique des réactions afin d'éviter la synthèse de produits non désirés. Ici, si on ne fait pas attention à la présence du Cl2, l'irradiation rien qu'à la lumière du Soleil peut être très dangereuse !